Jaki lek na okresowe braki leków? NIK sprawdza rynek farmaceutyczny
Działania ministra zdrowia oraz Inspekcji Farmaceutycznej w kontrolowanym okresie na rzecz poprawy dostępności produktów leczniczych wciąż nie były skuteczne. W konsekwencji zdarzało się, że w aptekach okresowo brakowało leków ratujących zdrowie lub życie - stwierdza Najwyższa Izba Kontroli, która zbadała rynek farmaceutyczny w Polsce. Mimo wprowadzania od 2015 r. ustawowych mechanizmów dostępność leków dla pacjentów nie była odpowiednio, kompleksowo monitorowana. Szczególnie mało skuteczne było przeciwdziałanie niekontrolowanemu wywozowi leków za granicę w ramach tzw. odwróconego łańcucha dystrybucji.

Rynek farmaceutyczny w Polsce notuje w ostatniej dekadzie stały wzrost i przedstawia obecnie wartość odpowiadającą około 1 proc. PKB, co czyni go największym rynkiem w Europie Środkowej i szóstym co do wielkości w Unii Europejskiej. Całkowita wartość krajowego rynku farmaceutycznego (apteczny, szpitalny oraz sprzedaże wysyłkowe e-aptek) wynosiła w: 2017 r. - 33,3 mld zł, w 2016r. - 31,7 mld zł, 2015 r. - 29,8 mld zł. Według firmy badawczej PMR rynek sprzedaży aptecznej będzie rósł i w 2021 r. osiągnie ok. 39,6 mld zł.
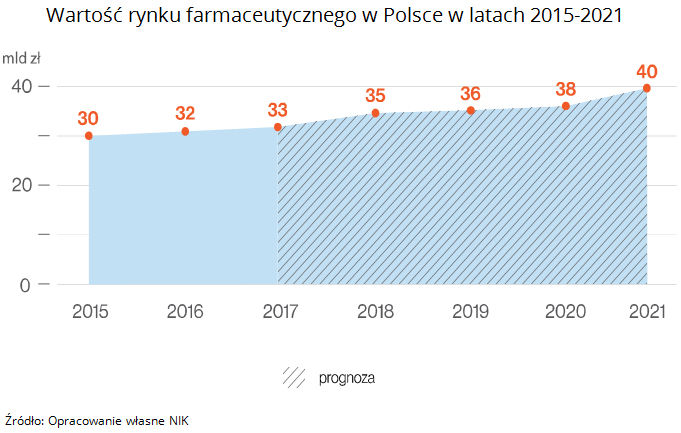
W wyniku wprowadzenia w 2012 r. urzędowych cen produktów leczniczych refundowanych oraz ich znacznej obniżki w Polsce po wprowadzeniu ustawy refundacyjnej, eksport niektórych grup leków stał się bardzo dochodowym przedsięwzięciem. Rosnąca skala eksportu doprowadziła w wielu przypadkach do braku leków w aptekach. Konsekwencją niekontrolowanego wywozu refundowanych produktów leczniczych, przy wykorzystaniu nielegalnego mechanizmu odwróconego łańcucha dystrybucji, było niezagwarantowanie pełnego i nieprzerwanego dostępu do leków ratujących zdrowie lub życie.
Komisja Europejska uznała, iż brak odpowiednich i ciągłych dostaw do aptek produktów leczniczych stanowi poważny i rosnący problem, który pojawił się w ostatnich latach w niektórych państwach członkowskich i który może mieć poważny wpływ na leczenie pacjentów. Komisja przyznała, że handel równoległy lekami może być jednym z powodów wystąpienia niedoborów wielu produktów leczniczych stosowanych u ludzi.
Najwyższa Izba Kontroli oceniła w kontroli P/15/109 z kwietnia 2016 r., że organy Państwowej Inspekcji Farmaceutycznej nie dysponowały wystarczająco skutecznymi instrumentami przeciwdziałania nielegalnym praktykom. Sytuacja ta dotyczyła zwłaszcza niekontrolowanego wywozu leków za granicę w ramach odwróconego łańcucha dystrybucji. Łączna wartość produktów leczniczych sprzedawanych do krajów UE wynosi 3,5 mld złotych, a według szacunkowych danych 57 proc. tych leków jest wyprowadzanych z kraju nielegalnie.
Obecna kontrola objęła działalność Ministerstwa Zdrowia, Urząd Głównego Inspektora Farmaceutycznego oraz Wojewódzkie Inspektoraty Farmaceutyczne w Białymstoku, Gdańsku, Kielcach, Opolu, Poznaniu i Rzeszowie w okresie od 2016 r. do 2017 r. (III kwartały).
Najważniejsze ustalenia kontroli
W ocenie NIK Minister Zdrowia opieszale prowadził prace nad nowelizacją Prawa farmaceutycznego, Objęły one m.in:
- zakaz jednoczesnego prowadzenia przez jednego przedsiębiorcę kilku rodzajów działalności gospodarczej, w zakresie której może on nabywać produkty lecznicze;
- zmianę kryteriów zatrudniania inspektorów ds. obrotu hurtowego w GIF;
- przepisy mające na celu zapobieganie konfliktowi interesów (oświadczenia o braku konfliktu interesów).
W znowelizowanych przepisach ustawy Prawo farmaceutyczne, wprowadzonych tzw. ustawą antywywozową założono, że wszyscy uczestnicy łańcucha dystrybucji leków począwszy od producenta, poprzez hurtownie i apteki są zobowiązani do regularnego raportowania stanów magazynowych oraz wielkości sprzedaży leków.
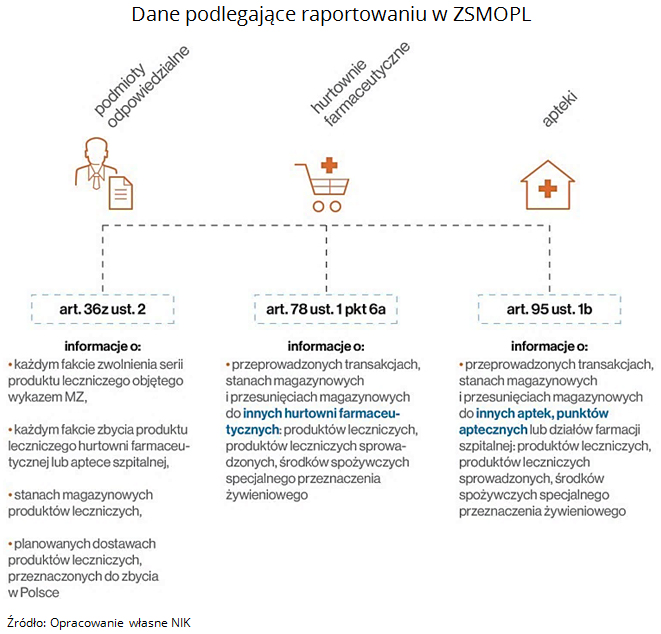
Prace nad wdrożeniem ZSMOPL trwały od 2012 r. Pomimo wejścia w życie od 1 stycznia 2017 r. obowiązku przekazywania informacji o obrocie produktami leczniczymi oraz przeprowadzonych transakcjach przez podmioty odpowiedzialne, hurtownie farmaceutyczne oraz apteki, w latach 2016-2017 w dalszym ciągu trwały prace pilotażowe, które ujawniały mankamenty w funkcjonowaniu ZSMOPL utrudniające jego pełne wdrożenie.
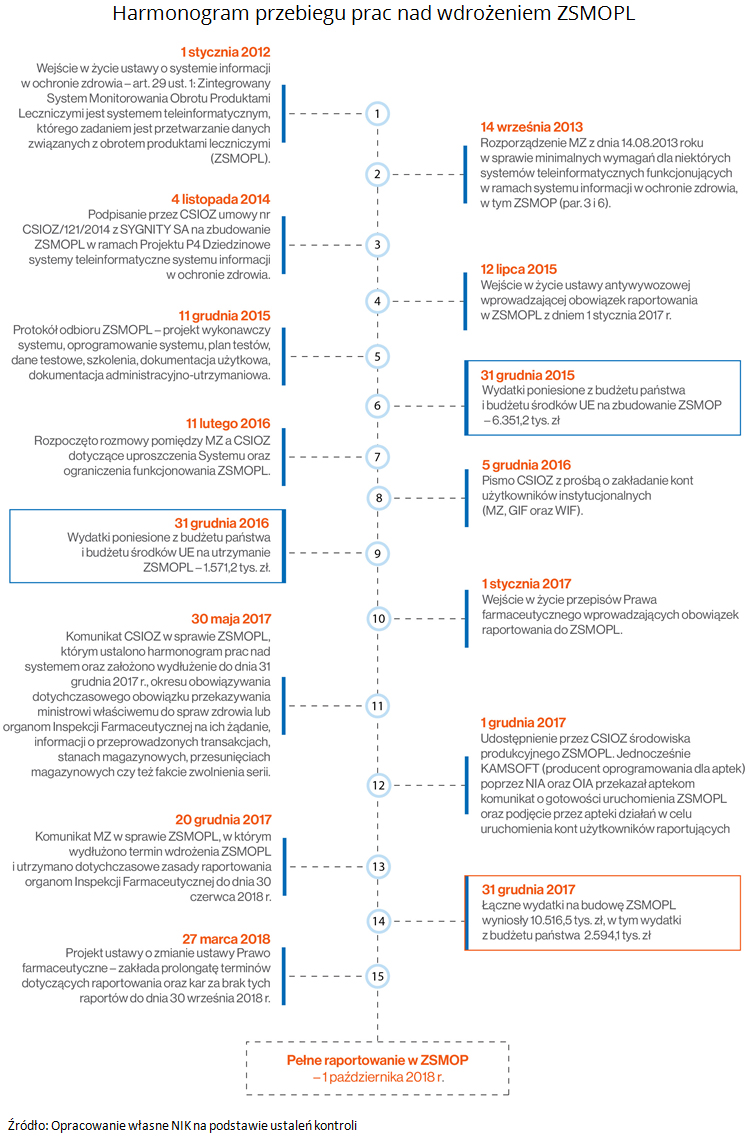
Wg stanu na dzień 31 stycznia 2018 r. do systemu podłączonych zostało 48,3% podmiotów raportujących oraz 100% podmiotów instytucjonalnych. Do podłączenia zobowiązanych było: 1500 podmiotów odpowiedzialnych (uogólniając: producentów leków i przedsiębiorców wprowadzających je do obrotu), 542 hurtownie farmaceutyczne, 16 567 aptek oraz 20 podmiotów instytucjonalnych (Ministerstwo Zdrowia, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, GIF i Wojewódzkie Inspektoraty Farmaceutyczne oraz Centrum Systemów Informacyjnych Ochrony Zdrowia).
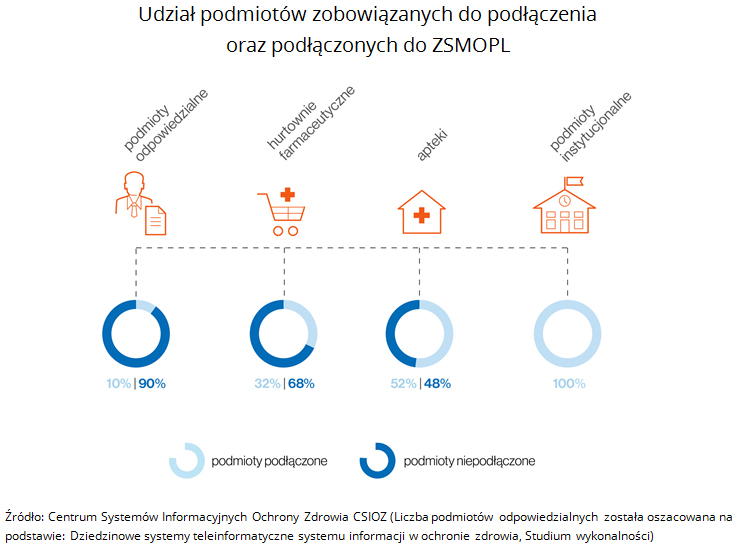
W związku z opóźnieniami termin rozpoczęcia pełnego raportowania do ZSMOPL po raz czwarty wydłużono - tym razem do 1 kwietnia 2019 r.
Mimo braku wdrożenia ZSMOPL skontrolowane organy Inspekcji Farmaceutycznej podejmowały działania na rzecz bieżącego przyjmowania zgłoszeń braku dostępności produktów leczniczych (monitorowania dostępności leków). Zarówno GIF, jak i Wojewódzkie Inspektoraty centralnie nie zostały wyposażone w jednolite narzędzie informatyczne do obsługi ogromnej liczby zgłoszeń braku zapewnienia dostępu do leków, jaka do nich wpływała z aptek pocztą elektroniczną.
Począwszy od 23 lipca 2015 r. WIF i GIF prowadziły zbieranie danych w zakresie zgłoszeń braku dostępności leków, a następnie raz w tygodniu sporządzały raport według wzoru ustalonego przez Ministra Zdrowia.
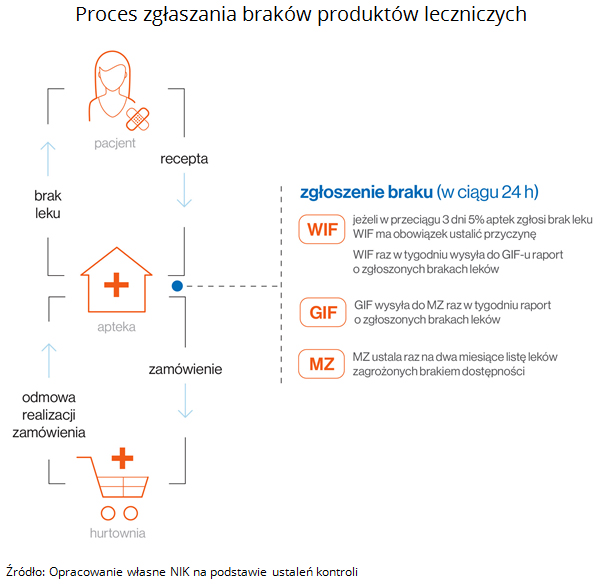
Ogromna liczba zgłoszeń napływających z aptek o brakach leków powodowała znaczne obciążenie Inspektoratów oraz zaangażowanie pracowników, najczęściej inspektorów farmaceutycznych. W miarę posiadanych możliwości część Inspektoratów uruchomiła narzędzia informatyczne ułatwiające gromadzenie i przetwarzanie zgłoszeń (np. poprzez zamieszczenie formularzy na stronie internetowej Inspektoratu, bądź utworzenie dedykowanych skrzynek mailowych). Większość skontrolowanych WIF rzetelnie wypełniała obowiązki w zakresie przyjmowania zgłoszeń braku dostępu produktów leczniczych oraz raportowania zgłaszanych braków do GIF - w 2016 r. przyjęły łącznie niespełna 180 tys. zgłoszeń, natomiast w III kwartałach 2017 r. - 44 tys. zgłoszeń. Braki w głównej mierze dotyczyły następujących leków: Berodual, Clexane, Fragmin, Humalog, Madopar, Xarelto. Najczęściej zgłaszane przyczyny braku lekarstw to:
- produkt niedostępny w sprzedaży,
- chwilowy brak produktu, dostawa w drodze,
- tymczasowy brak towaru w magazynie lokalnym,
- ograniczenie dostaw przez producenta,
- brak dostępności u producenta.
GIF na podstawie danych przekazanych z poszczególnych województw, sporządzał zbiorcze zestawienie, które przekazywał następnie raz w tygodniu do Ministerstwa Zdrowia.
W raporcie przedstawiano analizę skali i przyczyn braku dostępności do produktów leczniczych. Zbiorcze raporty sporządzane przez GIF nie zawierały informacji o skutkach braku dostępności produktów leczniczych, do czego zobowiązywało Prawo farmaceutyczne oraz wytyczne Ministra Zdrowia.
Zgodnie ze znowelizowanym w 2015 r. Prawem farmaceutycznym, placówki obrotu aptecznego zostały zobowiązane do składania zamówienia na leki w formie pisemnej lub w formie dokumentu elektronicznego. Również odmowa realizacji zamówienia musi nastąpić w formie pisemnej. W przypadku odmowy realizacji zapotrzebowania na leki zagrożone brakiem dostępności wymagane jest również uzasadnienie.
Do września 2016 r., z uwagi na brak uruchomienia Zintegrowanego Systemu Monitorowania Obrotu Produktami Leczniczymi, zgłoszenia odmowy realizacji zmówienia przyjmowane były od aptek za pośrednictwem elektronicznego formularza opublikowanego na stronie internetowej GIF, listownie, a także poprzez skrzynkę elektroniczną GIF. Od września 2016 roku, GIF udostępnił aptekom system Zgłoszeń Odmów Realizacji Zamówienia (ZORZ). W tym celu apteki zobowiązane były do założenia własnego konta w systemie. Od lutego 2017 r. do systemu podłączona została duża liczba użytkowników, co spowodowało istotny wzrost liczby zgłoszeń do poziomu ok. 700 tys. miesięcznie. Przełożyło się to na zwiększoną liczbę raportowanych odmów realizacji zamówień składanych przez apteki. Łącznie w bazie ZORZ na koniec lipca 2018 r. znajdowało się ponad 16,6 mln zgłoszeń odmowy realizacji zamówienia na leki.
Minister Zdrowia, co dwa miesiące publikował w formie obwieszczenia wykazy produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych zagrożonych brakiem dostępności na terytorium Polski, które były aktualizowane w oparciu o dane dotyczące zgłaszanych braków. Podstawą sporządzenia wykazów były informacje od Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych o stałym lub tymczasowym wstrzymaniu obrotu produktami leczniczymi przez podmioty odpowiedzialne oraz tygodniowe zbiorcze raporty GIF przygotowywane na podstawie zgłoszeń przesyłanych przez WIF.
W wykazie leków zagrożonych brakiem dostępności, publikowanym przez Ministra Zdrowia, w 2017 r. nadal znajdowało się od 173 (w styczniu) do 197 (w listopadzie) produktów leczniczych. Ich liczba rosła. Wg stanu na 15 września 2018 r. wykazem objętych było aż 266 pozycji leków.
W ocenie NIK Główny Inspektorat Farmaceutyczny nie wywiązał się z ustawowego obowiązku, polegającego na sprawdzeniu, nie rzadziej niż raz na trzy lata, czy przedsiębiorca prowadzący hurtownię farmaceutyczną spełnia obowiązki wynikające z Prawa farmaceutycznego. W 2016 r. nadzorem objętych było 550 hurtowni, zaś na koniec III kwartału 2017 r. - 543 hurtownie.

Jak ustaliła NIK rocznie średnio skontrolowano tylko około 10-12% hurtowni farmaceutycznych funkcjonujących na rynku. Co więcej, nawet pełne wykonanie planów kontroli nie gwarantowało realizacji ustawowego obowiązku, gdyż zapewniłoby kontrolę 23-24% tych podmiotów. Objęcie kontrolą ich niewielkiego odsetka uniemożliwiło skuteczny nadzór nad hurtowniami. Przyczyną tego stanu były niewystarczające zasoby kadrowe GIF. Dyrektor Departamentu Nadzoru GIF tłumaczyła, że przy zaledwie kilkuosobowej obsadzie inspektorskiej, a także przy założeniu, że każdą inspekcję przeprowadza dwóch inspektorów, nie jest możliwe dochowanie ustawowego obowiązku przeprowadzenia raz na trzy lata inspekcji w hurtowni. W okresie objętym kontrolą aż sześciu inspektorów ds. obrotu hurtowego zrezygnowało z pracy, a obecnie jeden jest w okresie wypowiedzenia. Zarobki inspektorów wahają się od 4,1 tys. zł do 5,9 zł brutto.
Nieskuteczne były też działania nadzorcze GIF w zakresie ujawniania odwróconego łańcucha dystrybucji. Liczba inspekcji, podczas których GIF stwierdził taki odwrócony łańcuch w okresie objętym kontrolą obejmowała: 16 przypadków w 2016 r. oraz pięć do końca III kw. 2017 r. Łącznie od 2015 (również przypadki stwierdzone w latach wcześniejszych) wszczęto 39 postępowań administracyjnych, jednakże w przypadku żadnego z nich stwierdzone transakcje nie skutkowały cofnięciem zezwolenia na prowadzenie hurtowni farmaceutycznej, a jedynie w czterech przypadkach skierowano zawiadomienia do organów ścigania.
NIK zauważa, że mimo stwierdzonych naruszeń Prawa farmaceutycznego GIF nie nakładał kar pieniężnych. Departament Prawny GIF prowadził siedem postępowań za prowadzenie apteki ogólnodostępnej bez wymaganego zezwolenia. Za taką działalność grozi kara do 500 tys. zł. Żadne z tych postępowań nie zostało zakończone, gdyż, jak wynikało z wyjaśnień, strony postępowania odmawiały udostępnienia dokumentów sprzedaży produktów leczniczych za okres prowadzenia apteki bez zezwolenia oraz faktur zakupu tych produktów. Kary nie były nakładane po wykryciu zbycia deficytowych produktów leczniczych bez wymaganego zgłoszenia do GIF zamiaru ich sprzedaży.
Fakt odstąpienia od nakładania kar GIF uzasadniał brakiem narzędzi pozwalających na ustalenie wartości rocznego obrotu netto, stanowiącego podstawę ustalenia wymiaru kary pieniężnej. Narzędzia takie jednak istnieją i są zapisane w Ordynacji podatkowej. W ocenie NIK wystarczyło zwrócić się do Krajowej Administracji Skarbowej o stosowne informacje stanowiące podstawę obliczenia wysokości kary. Jednak GIF tego nie zrobił. Pierwszą karę za wywóz za granicę produktów leczniczych zagrożonych brakiem dostępności na rynku bez zgłoszenia Inspektorat nałożył dopiero 12 września 2018 r. Wyniosła ona 47,1 mln zł.
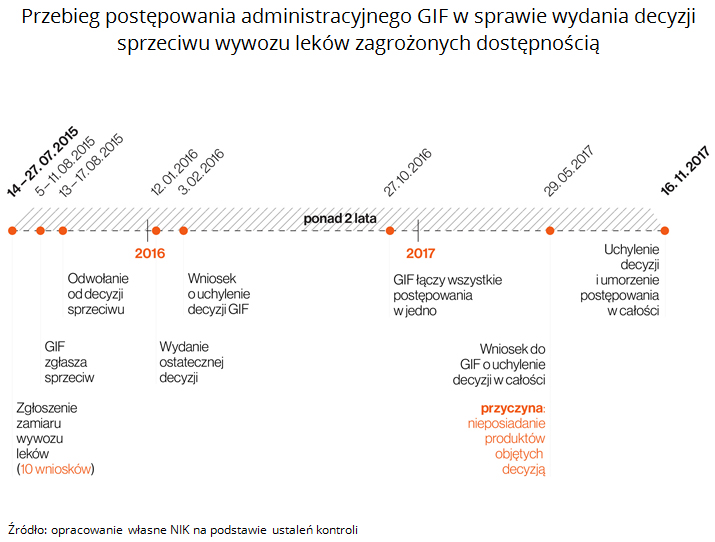
Do 31 grudnia 2016 r. GIF wydał 1.630 decyzji sprzeciwu zbycia lub wywozu leków deficytowych za granicę, z czego 1.268 zostało wydanych do końca 2015 r. W 2017 r. GIF nie wydał żadnej takiej decyzji, a jedyny wniosek jaki wpłynął został wycofany przez przedsiębiorcę. Spośród wydanych decyzji sprzeciwu, aż 1.476 (91% wydanych decyzji) dotyczyło zgłoszeń pochodzących od jednego przedsiębiorcy, spośród ponad 500 aktywnych hurtowni farmaceutycznych. Analiza 10 zgłoszeń o zamiarze wywozu deficytowych leków poza granice kraju, wykazała długotrwałość postępowania GIF, w konsekwencji czego po upływie ponad dwóch lat od zgłoszenia zamiaru wywozu - 16 listopada 2017 r. GIF był zmuszony uchylić decyzje I instancji i umorzył postępowanie w całości.
Nadzór nad obrotem detalicznym produktami leczniczymi sprawowany przez Wojewódzkie Inspektoraty Farmaceutyczne na koniec 2016 r. obejmował 18.305 placówek, na koniec III kw. 2017 r. - 18.932 placówki. Najliczniejszą grupę stanowiły apteki ogólnodostępne - ponad 13 tys. placówek. Średnio na jednego inspektora farmaceutycznego przypadało 131 i 141 placówek.
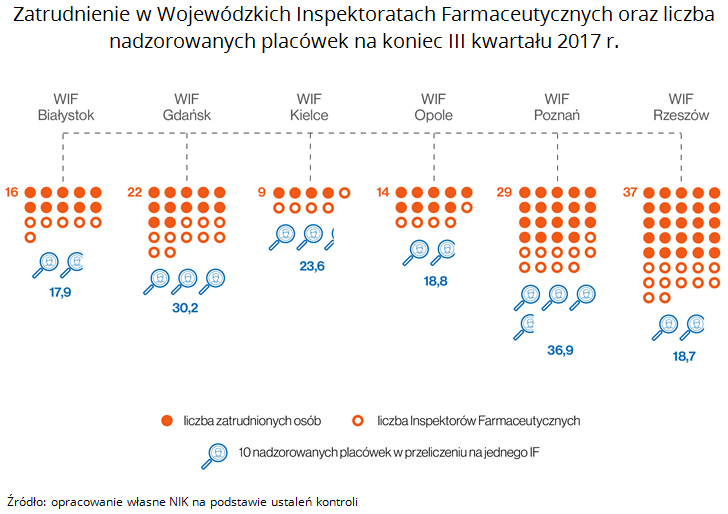
W ocenie NIK Inspektoraty nie w pełni rzetelnie sprawowały nadzór nad placówkami obrotu detalicznego produktami leczniczymi, na co niewątpliwy wpływ miały ograniczone zasoby kadrowe Inspekcji oraz mnogość prowadzonych postępowań.
Zatrudnienie w skontrolowanych Inspektoratach nie było wystarczające w stosunku do liczby nadzorowanych placówek oraz nowych zadań Inspekcji Farmaceutycznej związanych z wykrywaniem nielegalnego obrotu produktami leczniczymi. Nie pozwoliło to m.in. na pełną realizację planów kontroli w dwóch skontrolowanych WIF. Ponadto stwierdzono przypadki zaniechania monitorowania i egzekwowania wykonania zaleceń pokontrolnych. Nie wszczynano też postępowań administracyjnych w celu cofnięcia zezwolenia na prowadzenie apteki, w której stwierdzono sprzedaż leków do innej tego typu placówki.
Zastrzeżenia NIK budził fakt opublikowania na stronach Biuletynu Informacji Publicznej, przez Głównego Inspektora Farmaceutycznego oraz Wojewódzkie Inspektoraty Farmaceutyczne w Białymstoku, Kielcach i Opolu, wykazów placówek (nazwy i adresy) przewidzianych do kontroli w danych roku. Z wyjaśnień inspektorów wynikało, że robili to w celu zapewnienia transparentności działań kontrolnych oraz zgodnie z wytycznymi GIF.
Najwyższa Izba Kontroli zwróciła uwagę, iż żadne obowiązujące uregulowania prawne nie nakazują podawania do publicznej wiadomości (zamieszczanie w BIP) szczegółowych informacji o konkretnych podmiotach planowanych do objęcia kontrolą w danym roku.
Upublicznianie informacji w tym zakresie może powodować chęć zawieszenia działalności przez wskazanych do kontroli przedsiębiorców, a co za tym idzie może nie sprzyjać skuteczności działań kontrolnych.
W ramach koordynacji zadań Inspekcji Farmaceutycznej GIF nie wdrożył jednolitych procedur dotyczących przygotowywania planu pracy WIF, w tym planów kontroli. Nie wprowadzono też zasad prowadzenia bazy danych podmiotów objętych nadzorem zawierających dane o przeprowadzonych w nich kontrolach (tak jak to ma miejsce w przypadku planów kontroli GIF). Ustalone nieprawidłowości odnosiły się również do braku realizacji przez GIF planu kontroli WIF na 2017 r., nie zrealizowano bowiem żadnej z czterech zaplanowanych kontroli.
Skuteczne przeciwdziałanie nielegalnemu obrotowi produktami leczniczymi wymaga koordynacji i współpracy Inspekcji Farmaceutycznej z wieloma służbami i organami administracji państwowej. Kontrola NIK wykazała, że współpraca z organami administracji skarbowej, wojewodami oraz organami ścigania była nieskuteczna, nie wyeliminowano bowiem nieprawidłowości w obrocie produktami leczniczymi. Dopiero po upływie ponad roku od dnia wejścia w życie przepisów ustawy o Krajowej Administracji Skarbowej (1 marca 2017 r.) zawarto porozumienie o współpracy KAS i GIF. Dotychczasowe porozumienie z grudnia 2013 r. nie było zaktualizowane. Ścisła współpraca z KAS w ocenie NIK jest niezbędna dla właściwej realizacji działań nadzorczych Inspekcji Farmaceutycznej. Dzięki niej można przede wszystkim ujawniać dokumenty (faktury) dotyczące obrotu lekami oraz ustalać faktyczny obrót nielegalnie zbytych leków i nakładać kary pieniężne. Postępowania prokuratorskie z zawiadomienia organów Inspekcji Farmaceutycznej w większości przypadków były umarzane, albo odmawiano ich wszczynania.
Więcej www.nik.gov.pl





Komentarze